首页 >> 生活 >
阐明柔性网自噬体塑造的机制
北海道大学NobuoNoda教授领导的研究小组首次在体外重建了形成自噬体所需的膜内陷过程,表明该过程是由在自噬中起核心作用的Atg8蛋白和一组酶介导的进行其脂化反应。
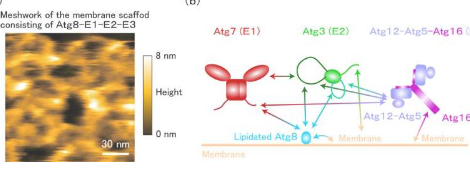
自噬是一种分解并再利用细胞中有害或不需要的物质的机制。此前已知Atg8和负责其脂化的E1、E2和E3酶在自噬中发挥核心作用,但它们在自噬体形成中的作用,特别是在形成其形状的过程中,人们知之甚少。
在体外实验中,研究小组发现,当所有脂化Atg8和E1-E2-E3酶都存在时,膜会内陷。此时,高速原子力显微镜和核磁共振分析表明,这些蛋白质通过本质上无序的区域在膜上形成灵活的高阶复合物。
此外,酵母实验证实,之前未知细胞内定位的E1酶在自噬体形成过程中也与Atg8、E2和E3酶一起定位于细胞膜。这些结果表明这些蛋白质共同作用形成自噬体。
这项研究揭示了自噬体形成的新机制,有望促进特异性调节自噬的药物的开发。研究结果发表在《自然结构与分子生物学》杂志上。
该研究团队包括微生物化学研究所的野田博士、高级研究员TatsuroMaruyama和博士后研究员MohammedJahangirAlam以及HitoshiNakatokawa博士(东京工业大学教授)的团队。
该结果来自JST战略基础研究计划团队的研究领域CREST:“细胞内成分的时空动力学”。研究课题是“多层次高阶结构成分驱动的自噬动力学”。
作者说,在这一领域,研究人员的目标是通过观察和测量细胞中从超分子复合物到细胞器和无膜细胞器的高阶结构的动态,并分析它们的功能相关性,来全面了解细胞。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
分享:
相关阅读
最新文章
-
截至2024年,大众探岳GTE的售价可能会因地区、配置和促销活动而有所不同。一般来说,2024款探岳GTE的价格可能...浏览全文>>
-
关于2025款途观L的价格信息,目前还没有官方发布。不过,根据以往的市场规律和车型更新周期,我们可以大致推测...浏览全文>>
-
根据您提供的信息,2024款广东东莞威然的最低售价为22 99万元起。关于具体的落地价,需要考虑以下因素:1 ...浏览全文>>
-
根据您的描述,生活家PHEV 2025款的最低售价为 63 98万元起。如果目前有促销活动或优惠政策,建议尽快咨询...浏览全文>>
-
奔腾T99作为一汽奔腾旗下的旗舰SUV车型,凭借其大气的外观设计、丰富的科技配置以及出色的性能表现,吸引了众...浏览全文>>
-
当然可以!以下是一个简单的试驾预约流程,帮助您轻松开启智蓝G5新能源的试驾之旅:1 确定需求- 车型选择...浏览全文>>
-
特斯拉的赛博越野旅行车(Cybertruck)自发布以来就引发了广泛关注。这款车型结合了皮卡的实用性、SUV的多功能...浏览全文>>
-
江淮悍途EV是一款纯电动皮卡,如果您想预约试驾,通常需要满足以下条件和准备以下信息:1 基本条件 - 年...浏览全文>>
-
截至我所掌握的信息,瑞驰新能源的ED75 2024款具体价格和配置可能会因地区、经销商以及政策补贴的不同而有所...浏览全文>>
-
在考虑购买上汽大众ID 4 X时,了解车辆的价格以及相关的购车费用是非常重要的。以下是一些关键信息和费用明...浏览全文>>
大家爱看
频道推荐
站长推荐
- 山东济南途观L新能源价格大公开,买车不花冤枉钱
- 东莞途岳最新价格2025款全分析,买车不踩坑
- 济南探岳GTE新车报价2024款,换代前的购车良机,不容错过
- 郑州ID.7 VIZZION多少钱 2024款落地价,配置升级,值不值得买?
- 郑州途锐新能源最新价格2024款,优惠购车,最低售价67.98万起
- 瑞虎7 PLUS新车报价2025款,买车前的全方位指南
- 广东东莞揽巡价格走势,市场优惠力度持续加大
- 轩逸新车报价2025款,买车前的全方位指南
- 飞凡R7新车报价2025款,换代前的购车良机,不容错过
- 试驾风光ix5,轻松搞定试驾
- 捷途山海L7预约试驾,从预约到试驾的完美旅程
- 试驾E福顺,从预约到试驾的完美旅程
- 长安星卡EV多少钱?选车指南与落地价全解析
- 凯翼E5 EV多少钱?如何挑选性价比高的车
- 标致408X预约试驾,快速操作,轻松体验驾驶乐趣
- 试驾星际牛魔王,新手必看的操作流程
- 岚图汽车岚图梦想家试驾预约,轻松几步,畅享豪华驾乘
- 影豹多少钱?全方位对比助你选车
- 豪运最新价格2023款,豪华配置超值价来袭
- 缤智多少钱 2025款落地价全解买车必看
