泛素化(蛋白质泛素的添加)是许多细胞过程的关键阶段,例如蛋白质降解、DNA修复和信号转导。金泽大学WPI-NanoLSI的HirokiKonno和HolgerFlechsig领导的研究人员利用高速原子力显微镜(HS-AFM)和分子模型,确定了泛素化相关酶铰链的移动性如何使泛素化发生。
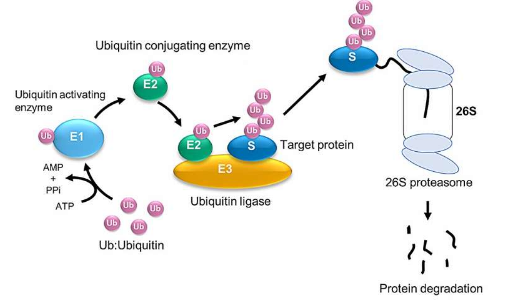
先前的研究已经鉴定出许多促进泛素化的酶,包括激活泛素的酶(E1)、缀合泛素的酶(E2)以及催化泛素蛋白与目标蛋白连接的酶(即连接酶,E3)。
HECT型E3连接酶的特征在于HECT结构域包含具有E2结合位点的N叶和具有催化Cys残基的C叶。柔性铰链连接两个叶,由此得出这样的假设:蛋白质围绕该铰链的重排促进了泛素化。
绀野和他们的合作者部署了高速原子力显微镜来寻找证据证明情况确实如此。该研究发表在《纳米快报》杂志上。
研究人员指出,当HECT结构域与一种E2酶一起结晶时,它会形成L形,使得HECT结构域的催化Cys残基与E2酶的催化Cys残基之间的距离为41Å,对于泛素的转移。然而,在其催化构象中,HECT结构域具有不同的形状,其中两个催化Cys残基之间的距离更近,仅8Å,因此这被认为是“催化构象”。
对E6AP野生型HECT结构域的HS-AFM图像分析揭示了两种构象,其中一个看起来是球形,另一个是椭圆形。使用AFM模拟,他们将椭圆形归因于L构象,而球形是催化构象或所谓的倒T构象,这种构象已在另一种类型的HECT结构域中观察到,其中Cys残基之间的距离为16Å。
为了克服成像的时空分辨率限制,实验辅以分子建模,以在原子水平上可视化HECT域构象运动。模拟AFM用于生成相应的伪AFM电影,清晰地显示了从球形到椭圆形形貌的变化。
“尽管实验限制不允许我们解析中间构象,”研究人员在他们的工作报告中解释道。“所进行的建模提供了证据,表明在HS-AFM下观察到的球形和椭圆形HECT结构域形状之间的转变对应于功能构象运动,在功能构象运动下,C瓣相对于N瓣旋转,从而允许催化和L形状之间的变化HECT构象。”
对铰链灵活性较低的突变HECT结构域进行的进一步实验表明,构象之间没有翻转——突变HECT结构域被锁定在催化构象中。他们还发现,这些突变的HECT结构域可以形成比野生型更有效地连接在一起的两个泛素蛋白。
E6AP,即本研究中的HECT型E3,与源自人乳头瘤病毒(HPV)的E6蛋白相互作用,并使肿瘤抑制蛋白p53泛素化。还已知E6AP和E6对p53的泛素化是宫颈癌的主要原因。然而,E6AP和E6蛋白相互作用导致p53泛素化的机制仍不清楚。未来,该团队将通过HS-AFM阐明E6AP/E6以及E6AP/E6/p53复合物的结构动力学,并阐明E6如何提高E6AP对p53泛素化的活性。
