所有动物的进化都要归功于数亿年前某些病毒感染原始生物的事实。病毒遗传物质被整合到第一个多细胞生物的基因组中,并且至今仍然存在于我们的DNA中。
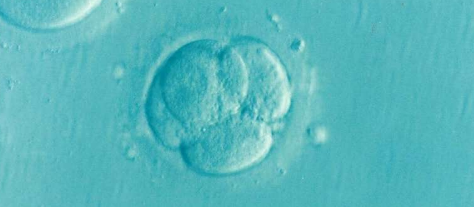
CNIO(西班牙国家癌症研究中心)的研究人员首次在《科学进展》杂志上描述了这些病毒在对我们的发育至关重要的过程中所发挥的作用,该过程发生在受精后几个小时:转变当卵母细胞从两个细胞变成四个细胞时,就具有多能性。
在这一步之前,胚胎的两个细胞都是全能的,即它可以在一个独立的生物体内发育;下一阶段的四个细胞不是全能的,而是多能的,因为它们可以分化成身体任何特殊组织的细胞。
对于第一作者和资深作者SergiodelaRosa和NabilDjouder来说,这一发现与再生医学领域和人造胚胎的创造相关,因为它开辟了一种在全能阶段生成稳定细胞系的新方法。Djouder领导CNIO的生长因子、营养素和癌症小组。
我们是8%的逆转录病毒
来自现在所谓的“内源性逆转录病毒”的遗传物质被整合到生物体的基因组中,这些生物体可能是寒武纪大爆发的驱动因素,寒武纪爆发是五亿多年前的时期,当时世界海洋经历了生物多样性“繁荣”。在过去的十年中,人们发现这些病毒的基因序列至少占人类基因组的8-10%。
“直到最近,这些病毒残留物还被认为是‘垃圾DNA’,即无法使用甚至有害的遗传物质,”德拉罗莎解释道。“直觉上,人们认为基因组中存在病毒并不好。然而,近年来我们开始意识到,这些与我们共同进化了数百万年的逆转录病毒具有重要的功能,例如调节其他基因。这是一个非常活跃的研究领域。”
从全能性到多能性的转变,一个速度问题
研究表明,MERVL内源性逆转录病毒决定了胚胎发育的速度,特别是在从全能性向多能性转变的具体步骤中,并解释了实现这一目标的机制。
“对于内源性逆转录病毒来说,这是一个全新的角色,”Djouder说。“我们发现了一种新机制,可以解释内源性逆转录病毒如何直接控制多能性因子。”
这种新的作用机制涉及URI,这是Djouder团队正在深入研究的一个基因。多年前,人们发现,如果实验动物体内的URI被删除,胚胎甚至无法发育。DelaRosa想要找出原因,以及它与MERVL逆转录病毒的联系是如何被发现的。
平稳过渡
研究结果表明,URI的功能之一是使获得多能性所必需的分子发挥作用。如果URI不发挥作用,多能性因子也不发挥作用,细胞仍处于全能性状态。事实证明,它是一种内源性逆转录病毒蛋白MERVL-gag,可调节URI的作用。
研究人员发现,在全能期,当卵母细胞中只有两个细胞时,MERVL-gag病毒蛋白的表达量很高;这种蛋白质与URI结合并阻止其发挥作用。然而,水平逐渐发生变化,使得MERVL-gag病毒蛋白的水平下降,URI可以开始发挥作用:出现多能性。
正如DelaRosa解释的那样,“这是一个平稳的过渡。当病毒蛋白高表达时,多能因子就会减少;随着ERV表达的减少,URI会稳定这些因子。”
共生共同进化
“我们的研究结果揭示了内源性逆转录病毒与其宿主细胞的共生共同进化,以保证早期胚胎发育的顺利和及时进展,”作者解释道。
换句话说,病毒蛋白、URI和多能性因子之间的三向关系得到了精细调节,“以便胚胎有足够的时间来调整和协调胚胎发育过程中从全能性到多能性的平稳过渡以及细胞谱系规范”。朱德尔总结道。
