基因组编辑正在进军生物医学研究和医学领域。通过采用生物分子建模工具,日本研究团队正在加快锌指核酸酶(ZFN)技术(一种主要的基因编辑工具)的发展步伐并降低其成本。
在《Advanced Science》杂志上发表的一项研究中,广岛大学和日本国家先进工业科学技术研究所的研究人员展示了机器学习驱动的模块化组装系统如何改进基因编辑。
广岛大学基因组编辑创新中心副教授 Shota Katayama 表示:“基因组编辑是治疗许多不同领域遗传性疾病的一种很有前途的工具。” “通过提高基因编辑技术的效率,我们可以更精确地修改活细胞中的遗传信息。”
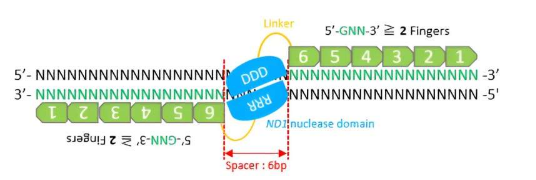
锌指核酸酶与 CRISPR/Cas9 和 TALEN 一样,是基因组编辑领域的重要工具。这些嵌合蛋白经过工程设计,可破坏 DNA 分子多核苷酸链内的某些键,由两个融合在一起的结构域组成:DNA 结合结构域和 DNA 切割结构域。锌指 (ZF) 蛋白结合结构域识别完整基因组内的目标 DNA 序列,而切割结构域则涉及一种称为 ND1 核酸内切酶的特殊 DNA 切割酶。
ZFN 比 CRISPR/Cas9 和 TALEN 具有一些优势:首先,与 CRISPR-Cas9 不同,ZFN 的专利已经过期,无法在工业应用中收取高额专利使用费。其次,ZFN 更小,使得 ZFN 编码 DNA 可以轻松包装到病毒载体中,且货物空间有限,适合体内和临床应用。
为了切割 DNA,必须结合两个 ZFN。因此,它们必须成对设计才能在任何新站点上发挥作用。然而,构建功能性 ZFN 并提高其基因组编辑效率已被证明具有挑战性。
Katayama 说:“我们在为新基因组目标衍生锌指组的方法方面取得了巨大进步,但我们的设计和选择方法仍有改进的空间。”
基于选择的方法可用于构建组装的 ZF 蛋白,但这些方法是劳动密集型且耗时的。构建组装 ZF 蛋白的另一种方法是使用标准分子生物学技术组装 ZF 模块。该方法为研究人员提供了一种更简单的方法来构建组装的 ZF 蛋白。
然而,模块化组装的 ZFN 具有少量功能性 ZFN 对,测试的 ZFN 对的故障率为 94%。
在他们的研究中,广岛大学和日本国家先进工业科学技术研究所的研究人员旨在利用模块化组装系统中的公开资源来创建一种更高效、更容易构建的锌指核酸酶,用于基因编辑。
ZFN 设计中的一个重要考虑因素是高效和特异性裂解所需的锌指数量。该团队假设 ZF 模块的模块化组装对于构建具有五个或六个手指的 ZFN 非常有用。
在他们的出版物中,研究小组提出了一种使用三种生物分子建模工具:AlphaFold、Coot 和 Rosetta 来提高功能性 ZFN 构建效率及其基因组编辑效率的方法。
在测试的 10 个 ZFN 中,研究人员获得了两个功能对。此外,使用AlphaFold、Coot和Rosetta对ZFN进行工程化,使基因组编辑效率提高了5%,证明了基于结构建模的ZFNs工程化的有效性。
