过去 20 年来,合成生物学家一直在尝试在活细胞中构建生物电路,以实现布尔逻辑门、信号滤波器、振荡器、状态机、传感器和基因控制器等特定行为。这些电路是通过将基因“部件”与某些交换逻辑连接起来,自下而上地从头构建的。
然而,这些成果主要局限于大肠杆菌和酿酒酵母等少数模式生物。由于宿主特异性的基因表达机制、代谢和不同的 DNA 载体,将这些遗传部分转移到非模式生物中具有挑战性。
因此,开发能够在多种生物体中稳健且可预测地运行的通用遗传电路至关重要。理想的通用遗传电路应与宿主环境隔离,包括细胞外、细胞和遗传环境。
北京大学欧阳谦实验室和中国科学院楼实验室合作团队在《定量生物学》杂志上发表了题为“多种微生物宿主中通用基因回路的功能可预测性”的文章。
研究团队通过建立定量框架探索非模式生物中生物部件的普适性和可靠性,在链霉菌、谷氨酸棒杆菌、恶臭假单胞菌和大肠杆菌四种微生物宿主中表征了通用的遗传部件,即T7 RNA聚合酶激活模块和一组转录抑制模块,并基于这些部件优异的普适性,严格证明了遗传回路功能的可预测性。
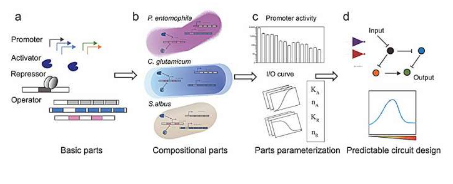
跨不同物种的遗传回路自下而上的设计流程始于源自细菌和噬菌体的转录调控元件的标准化,用单一反应模型对这些元件进行基准测试,以确保它们在宿主生物中表现一致。
随后,通过详细建模对部件进行组合表征和参数化。从测量中提取定义这些部件行为的关键参数,并将其归类为内在或宿主特异性。最后,将标准化部件组合成复杂电路,并使用组合建模和模拟来预测不同宿主生物中的电路行为。
浙江大学的王宝军教授在同一期发表的评论文章中写道:“这些发现为可预测地设计和调整具有复杂功能的通用遗传电路铺平了道路,并为实现不同宿主中通用电路的设计自动化具有巨大的潜力。”
